| 1.染色体構造変化の解析 | 2.染色体構成を不安定にする変異 | 3.酵母-菌糸:二形性変換のメカニズム |
 |
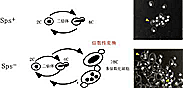 |
 |
| 1.染色体構造変化の解析 | 2.染色体構成を不安定にする変異 | 3.酵母-菌糸:二形性変換のメカニズム |
 |
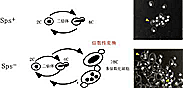 |
 |
1. 染色体構造変化の解析
生物の染色体数は種によって決まっていて、同一種内では各染色体の大きさもほぼ同じです。
染色体構造に変化が生じると様々な影響が現れます。たとえば、ヒトでは染色体数の変化によって様々障害が引き起こされ(13-trisomy、21-trisomyなど)、また、染色体転座はガン化の要因の一つとしても知られています(フィラデルフィア染色体など)。
健康なヒトの口の中や腸内に常在しているCandida albicans(C. albicans)は、日和見感染の起因菌として、エイズ、白血病、臓器移植など免疫能力の低下した患者にとって、重篤な感染症を引き起こす真菌です。通常二倍体で存在しており、有性生殖過程(性)が見つかっていないことから、不完全菌類に分類されています。患者さんから分離されてくる菌株を比較すると、薬に対する耐性の程度、酵母・菌糸型の二形性変換、細胞へ付着のしやすさといった様々な形質において、大きな差が見られることが知られています。染色体電気泳動法(パルスフィールド電気泳動法:PFGE)によってこの酵母菌の染色体(DNA)を分離すると、通常1.0から4.2Mbの大きさの8本の染色体DNAバンドが検出されますが(レーン1)、およそ40%の菌株では著しい多様性が見いだされます(レーン2〜18)。すなわち、同一種内であるにもかかわらず、染色体の大きさや数が大きく異なっています。
図1 染色体電気泳動核型(パルスフィールド電気泳動法)
この染色体核型を用いることによって、患者さんから分離されてくる菌株を識別することが可能で、感染源の特定に用いることもできます(Doi et al., 1994)。さらに、C. albicansのゲノムを稀にしか切断しない制限酵素を用いた染色体物理地図の作製から、この染色体核型の多様性の原因の一つが異なる染色体間の組換え(染色体転座)によることが明らかにな りました(図2、Iwaguchi et al., 2001)。
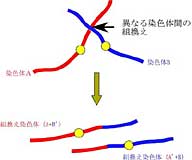
図2 染色体転座
染色体転座の連結点には3種類の反復配列RB2、RPS、HOKから成るMajor Repeat Sequence(MRS)が存在しています。各染色体上に1ないし2個存在しているMRSが、相互組換えの鋳型として染色体転座に関与していると予想されています。MRSを構成しているRB2、RPS、HOKのどの要素が染色体転座に重要であるかを調べたところ、RB2配列へブラスターを挿入したときだけ、染色体転座を誘導するという条件を発見しました。さらに形質転換体には高度のアゾール耐性を示す菌株や染色体5モノソミー状態を示す菌株が見いだされました(Iwaguchi et al., 2004)。
染色体転座は、二倍体で、有性生殖を行わないC. albicansが、形質の多様性を獲得するメカニズムの一つとして働いているのではないかと考えています。染色体転座の生じるメカニズムと、その結果生じる形質の変化について研究を行っています。
1.1 染色体転座に伴う表現型変異と当該遺伝子の単離
1.2 反復配列を介した染色体転座の誘導とそのメカニズム
1.3 染色体転座を制御する因子の検索
C. albicansの株には、通常よりも高頻度に集落形態が異なる変異体を生じるものがあります。これらの株では、細胞集団中の大部分は二倍体ですが、一部の細胞では多倍数化が生じ、核の巨大化、多核化がみられ、細胞自体も大きくなっています。また、多倍数化した細胞であっても、その子孫クローンからは低次の核相をもった娘細胞を生じます。こうした現象は、倍数性変換(plodiy shift)とよばれ、倍数性を制御するSPS (suppressor of ploidy shift)遺伝子群に変異が起きているために、二倍体を維持できなくなって生じていると考えられます。倍数性変換を生じる株の表現型はSps-で表し、それに対し、核相が一定である株の表現型はSps+表されます。
この遺伝子群は少なくとも3つに分類され、そのうち、Sps1-であるSGF7-2株では倍数性変換を示すとともにADE1遺伝子座においてヘテロ接合からホモ接合が出現する異型接合性の喪失(Loss of Heterozygosity : LOH)が生じています。LOHはガン化のメカニズムの一つとして知られている現象です。また、Sps2-であるSTN21株では倍数性変換を示すとともに、染色体転座の頻度が上昇することを報告しています(Iwaguchi et al., 2000)。これらの変異株を用いて、染色体構成の安定化のメカニズムの解析を行っています。
2.1 異型接合性の喪失(LOH)を伴う倍数性変換を制御する遺伝子SPS1の解析
2.2 染色体再編成を伴う倍数性変換を抑制する遺伝子SPS2の解析
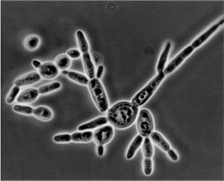
同一生物あるいは個体が2つの異なる形態をとることを一般に二形性 (dimorphism)と呼びます。菌類には生育環境により単細胞性の酵母型と多細胞性の菌糸型との増殖形態をとるものが知られ、この異なる形態を相互変換することから二形性変換 (dimorphic transition) と呼ばれています。二形性酵母C. tropicalisは、土壌から分離される石油資化酵母で、生育環境を制御することにより、出芽による酵母型増殖と菌糸成長による菌糸型増殖の二つの異なる増殖形態をとる二形性菌です。グルコースを炭素源とした合成液体培地で培養すると、単細胞性の出芽増殖による酵母型を示しますが、グルコース合成培地にさらにエタノールを2.5%添加した培養では成長曲線は二相性を示し、第二相に入って菌糸の成長が見られます(Suzuki et al., 1998)。
酵母型から菌糸型への二形性変換過程を制御する遺伝子を単離することを目的として、菌糸成長をする前段階の時期の細胞を用いたサブトラクション法を行い、いくつかのクローンが得られています。この中にはMAPキナーゼホスファターゼ相同遺伝子CtPP1の他、未知の遺伝子も多数得られています(Imanishi et al., 2001)。これらの遺伝子の菌糸形成での役割について、分子遺伝学手法により解析しています。
3.1 MAPキナーゼ、MAPKホスファターゼ遺伝子の解析
3.2 PLC1(ホスフォリパーゼC)遺伝子の解析
3.3 菌糸形成特異的発現遺伝子群の解析
<参考文献 >
Doi, M., Homma, M*., Iwaguchi, S., Horibe, K. and Tanaka, K. (1994). Strain relatedness of Candida albicans strains isolated from children with leukemia and their bedside parents. Journal of Clinical Microbiology 32: 2253-2259.
Suzuki, T.*, Imanishi, Y., Iwaguchi, S., and Kamihara, T. (1998). Depolarized growth precedes filamentation during the process of ethanol-induced pseudohyphal formation in the yeast Candida tropicalis. Microbiology 144: 403-410
Iwaguchi, S.*, Kanbe, T., Tohne, T., Magee, P. T. and Suzuki, T. (2000). High-frequency occurrence of chromosome translocation in a mutant strain of Candida albicans by a suppressor mutation of ploidy shift. YEAST 16: 411- 422
Imanishi, Y.*, Kawai, T., Iwaguchi, S., Suzuki, T., Kamihara, T., Yokoyama, K., Nishimura, K. (2001). Subtractive gene cloning using dynabeads oligo(dT)25 for elucidation of pseudohyphal formation in Candida tropicalis. Japanese Journal of Medical Mycology 42 (4): 243-251
Iwaguchi, S.*, Sato, M., Magee, B. B., Magee, P. T., Makimura, K. and Suzuki, T. (2001). Extensive chromosome translocation in a clinical isolate showing the distinctive carbohydrate assimilationprofile from a candidiasis patient. YEAST 18: 1035- 1046
Iwaguchi, S.*, Suzuki, M., Sakai, N., Nakagawa, Y., Magee, P. T., and Suzuki, T. (2004). Chromosome translocation induced by the insertion of the URA blaster into the major repeat sequence (MRS) in Candida albicans. YEAST (in press)