最新の研究紹介
酵素の働く仕組みを化学の力で解き明かす
 [ リリース: 2016.11 ]
[ リリース: 2016.11 ]
奈良女子大学研究院自然科学系 教授 藤井浩
私たちの体内には、たくさんの酵素と呼ばれるタンパク質が存在し、生命活動に必要な多くの化学反応を行っています。例えば、食事で摂取した食物を消化することやそうして体内に取り入れた物質を使って生命活動に必要な物質やエネルギーを合成するのも酵素が行っているのです。これら酵素は、非常に温和な条件で、しかも特定の物質の特定の部位にのみ化学反応を誘導できるという非常に優れた特性を持っています。酵素と同じ反応を化学者が試験管内で化学的に行うことはたいへん困難であり、たくさんのエネルギーや時間を必要としたり、あるいは目的の物質とは異なる不要な物質までも生成したりするのです。酵素がどのような仕組みでこの優れた機能を獲得し発現しているのかを解明することは、生命の仕組みを分子のレベルで知ることができるだけでなく、病気のしくみや治療のための薬の開発、さらには人工酵素のような新しい物質の開発につながると考えています。こうした酵素の研究は、これまでのような生物学的な立場だけでなく、化学反応に関する知見を持った研究者が化学的な立場から研究しないと達成できない課題なのです。私の研究室では、化学的知見から生体内の酵素の働く仕組みを研究しています。特に酵素の中でも鉄や銅、ニッケルなどの金属イオンをもった酵素(金属酵素)の研究を行っています。酵素は、金属イオンを取り込むことによりさらに強力な酵素に変身できるのです。私たちの体内でこうした金属イオンが不足すると体調が悪くなりますが、これも金属酵素と深い関わりがあるのです。ここでは、私の研究室で行った最近の研究成果を紹介します。
チトクロームP450による芳香環水酸化反応の反応機構の解明
私たちの体内では、呼吸で体内に取り入れた酸素を使った生命活動に必須の物質を合成したり、逆に不要になった物質を分解したりする酵素があります。その代表が、チトクロームP450という酵素です。この酵素は、我々人間だけでなく地球上のほとんどの生物が生命活動に利用している酵素です。この酵素は、図1に示すように活性部位(酵素の中で反応を行うための場所)にヘムと呼ばれる分子をもち、ヘム内の鉄イオンが酵素機能の源となっています。チトクロームP450にはたくさんの種類があり、それぞれが異なった機能を持っています。
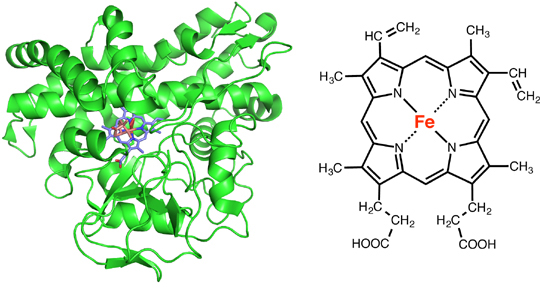
図1.チトクロームP450カンファーの全体構造
(左:緑色のリボンはタンパク質、薄紫色で示したものが活性部位のヘム)と活性部位のヘムの化学構造
チトクロームP450が行う代表的な反応の中に、ベンゼンのような芳香族化合物の水酸化反応があります。チトクロームP450が行う芳香族化合物の水酸化反応の例として、花の色を決定する過程があります。多くの花は、アントシアニンという物質によって花に色を付けます。アントシアニンは、図2に示すように3つの芳香環(A,B,C)からなる分子であり、構造により赤〜オレンジ〜紫〜青と変化します。この色を決める一番の要因は、フラボノイドのB環の水酸基(OH)の数です。B環に水酸基が1つあるとオレンジ色、2つあると赤色、3つあると青色を呈します。このB環の水酸化反応は、チトクロームP450によって行われているのです。この例からもわかるようにチトクロームP450による芳香族化合物の水酸化反応は、生物にとって欠かすことのできない極めて重要な反応です。では、酵素はいったいどのようにしてこの反応をおこなっているのでしょうか?
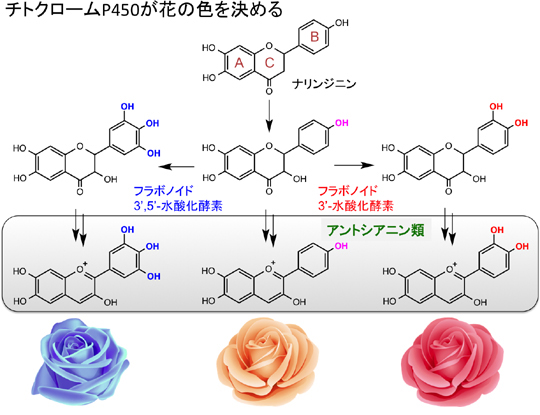
図2.チトクロームP450による芳香環水酸化反応による花の色の決定機構
これまで多くの研究がなされた結果、チトクロームP450の活性部位のヘムが酸素と電子とプロトンにより活性化され、高酸化状態の反応性の高い活性種が生成されることが明らかにされましたが、その後この活性種どのように芳香族化合物を水酸化するのかは未解明でした。私の研究室では、この水酸化反応の機構を酵素の活性種のモデル化合物を人工的に合成し、詳細に研究しました。その結果、図3に示すようなこれまでにない反応機構を実験的に提唱することに成功しました。私たちは、水酸化反応の律速段階で酵素の高酸化状態の活性種と芳香族化合物の間で電子移動が起こることを見いだし、この電子移動の過程が活性種と芳香族化合物間の結合生成過程と共役するという新しい機構を提案しました。この新しい機構は、これまでに報告された水酸化反応に関する多くの実験結果を矛盾なく説明することができる唯一の機構となりました。この研究成果に関する論文は、本年度、アメリカ化学会誌(Journal of American Chemical Society)に掲載されました。また、アメリカ化学会誌の掲載週のホームページにおいてバナーとして取り上げられ紹介されました。この研究は、私の研究室のM2の浅香茉彩さんが中心となって行った成果です。現在、M1の福井奈美さんと4年生の石水友梨さんがさらにこの成果を発展させる研究を行っています。
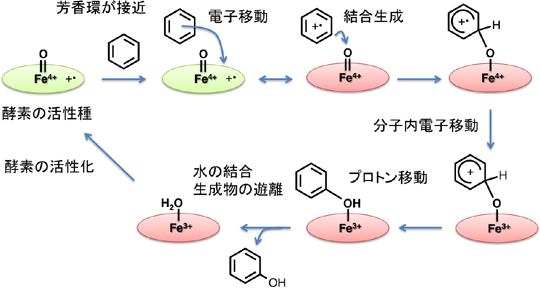
図3.我々が提案したチトクロームP450による芳香環水酸化反応の機構
この他にも私の研究室では、白血球が体内に侵入した細菌を撃退するために使う次亜塩素酸(漂白剤の主成分)を合成する酵素(例えばミエロペルオキシダーゼ:我々人間は漂白剤と同じ物質を体内で作り、しかもそれを使って細菌を撃退しているのです)、生物の体内で鉄イオンのリサイクルに関わる酵素(例えばヘムオキシゲナーゼ)、地球の窒素化合物のバランスを保つために役立っている土壌細菌中の酵素(例えば亜硝酸還元酵素)などの機構の研究も行っています。こうした研究は、M1の荒木郁子さんと横田紗和子さん、4年生の難波照代さんががんばって行っています。
自然は多くの酵素を使って多様な生命反応を行っているため、一見非常に複雑で収拾がつかないように見えますが、私はこうした多様性の中に多くの生命反応を支配する単純で美しい決まりごとがあると考えています。今後も酵素の機構の研究を通して、自然の美しさを見いだすことができるように研究を続けていきたいと思っています。
本研究に関する最近の論文
(1) Maaya Asaka and Hiroshi Fujii
Participation of Electron-Transfer Process in Rate-Limiting Step of Aromatic Hydroxylation Reactions by Compound I Models of Heme Enzymes
Journal of American Chemical Society 2016, 138, 8048-8051
http://pubs.acs.org/doi/pdf/10.1021/jacs.6b03223
(2) Toshitaka Matsui, Shusuke Nambu, Celia W. Goulding, Satoshi Takahashi, Hiroshi Fujii, and Masao Ikeda- Saito
Unique coupling of mono- and dioxygenase chemistries in a single active site promotes heme degradation
Proceedings of National Academy of Sciences of USA 2016, 113, 3779-3784
http://www.pnas.org/content/113/14/3779
(3) Hiroshi Fujii, Daisuke Yamaki, Takashi Ogura, and Masahiko Hada
The Functional Role of the Structure of the Dioxo-isobacteriochlorin in the Catalytic Site of Cytochrome cd1 for the Reduction of Nitrite
Chemical Science 2016, 7, 2896-2906
http://pubs.rsc.org/en/content/articlepdf/2016/sc/c5sc04825g

