最新の研究紹介
A Long and Winding Road:ワールブルグ博士とがん細胞と奈良女子大学
 [ リリース: 2020.02 ]
[ リリース: 2020.02 ]
奈良女子大学理学部 化学生命環境学科 生物科学コース 渡邊利雄
研究者の楽しみの一つには、共同研究を通じて本学以外の研究者とお互いの得意技を生かすことで単独ではなかなか手が届かない高みに手が届き、時に自分でも感心するような成果を得られるということがある。とは言え国内は言うに及ばず国外との研究でも遠距離での共同研究は苦労が多い。最近の生物学研究は完成までに時間もかかり、なかなか大変です。幸いにも本学でそのような経験をして、12年かかりましたが面白い研究成果を公表できたので今回ご紹介いたします。
がんの健診でPETと言う言葉を聞いたことがあるかもしれません。これは、「がん細胞がブドウ糖/グルコースを多量に取り込む」という特性を利用して、目に見えないがん細胞の塊(腫瘍)を見つける検査法です(図1)。
図1.ワールブルグ効果とPET検査の説明
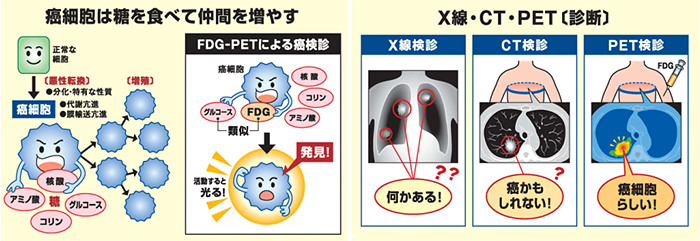 がん細胞は正常細胞の何倍もの量のグルコースを取り込むので、グルコースと同じ挙動を取る18F-FDG(放射性物質)を注射するとがんの病巣に集まります。集まったところからは放射線が放出されるので、それを捕らえて画像化してがんの病巣を見つけ出すことができます。(http://www.hosp.ncgm.go.jp/s037/010/010/pet.htmlから引用)
がん細胞は正常細胞の何倍もの量のグルコースを取り込むので、グルコースと同じ挙動を取る18F-FDG(放射性物質)を注射するとがんの病巣に集まります。集まったところからは放射線が放出されるので、それを捕らえて画像化してがんの病巣を見つけ出すことができます。(http://www.hosp.ncgm.go.jp/s037/010/010/pet.htmlから引用)
この「がん細胞がブドウ糖(グルコース)を多量に取り込む」という性質は、100年ほど前にノーベル賞受賞者のOtto Warburgが観察した現象で、Warburg(ワールブルグ)効果と呼ばれます。がん細胞は有酸素下でも効率の良いミトコンドリアの酸化的リン酸化よりも、効率の極めて悪い解糖系で生物がエネルギー源として使うATPを産生するのです。グルコースは解糖系で代謝された後にミトコンドリアに入ることなくピルビン酸キナーゼ(PKM)によってピルビン酸に変換され、がん細胞は大量のグルコースを消費することになります(この辺は高校の生物の教科書に詳しく書いてあります)。これらのATP産生の切り替えに係るPKMですが、1つの遺伝子から2つの性質が異なるPKM1とPKM2がmRNAの選択的スプライシングという現象によって生み出されることが判明していました(図2)。
図2. PKM遺伝子からは2つのタンパク質ができる
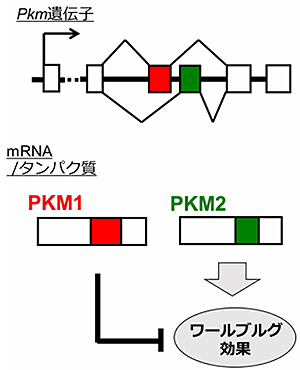
1つの遺伝子から2つの性質が異なるPKM1とPKM2がmRNAの選択的スプライシングという現象によって生み出される。図では、赤い四角を使えばPKM1、緑の四角を使えばPKM2となる。PKM2がワールブルグ効果の原因とされる。(生化学 第91 巻第1 号,pp. 38?43(2019)より図の一部を引用)
共同研究者の田沼さん(宮城がんセンター研究所)は、PKM1とPKM2とを区別できる抗体を作製し、がん組織ではPKM2陽性のものが多いことから、これら両方の機能と発がんとの関連を解析しようと、14年前に提案してきました。私も奈良女子大へ赴任したばかりで学生も少なく、彼の上司の島さんと新しいがん抑制機構の解明を目指して脱リン酸化酵素PP6の欠損マウス作製を始めていました。このためウーマンパワー不足でもあったのですが、直感的に面白そうだったので、学生を説得して共同研究を始めました。
遺伝子の働きを調べるためには遺伝子の働きを無くすことが多いのですが、mRNAの選択的スプライシングという現象があるので、一方を無くしてももう一方が動く可能性があります。そこで、もともとあるPKM1, PKM2は発現させずに、外から入れたPKM1, PKM2のどちらか一方だけが発現するマウスの作製を行いました。とは言え、将来の癌治療への応用の特許も視野に入れていたので(左うちわ計画と呼んでいました)、公的な理研での実験ができません。かといって会社に外注すると1種類に最低うん百万円は支払うことになり、実験を行う先を探すのに苦労しました。結果的に交渉を繰り返し、京大(実費でうん十万円)とベンチャー(ステップの大半を我々が行うことで80%ディスカウント)と組んでマウスを作製しました。
そうこうしているうちにNatureにがん細胞の腫瘍形成にはPKM2が大事との極めてクリアーな論文が公表され腰を抜かしました(1)。それからは、PKM遺伝子破壊の論文が出て、mRNAの選択的スプライシングの大御所、はては昨年ノーベル賞を受賞した低酸素応答の大家までもが自分の因子とPKMとの関係という形で研究に参画してきました。著名な学術論文に多数の結果が、ほんとかと思う論文もありましたが、掲載されました。正直なところ、このままでは時期を失い自分たちの成果は公表できないのではないだろうかと、共同研究者一同戦々恐々としていました。
ところが案ずるは産むがやすしです。マウスが出来上がりいざ解析を始めると、驚いたことに発癌実験ではPKM2を発現するマウスではがんを発症しませんが、PKM1を発現するマウスではがんを多数発症するという、Natureの論文とは真逆の結果となりました。最初はえっと驚きましたが、実験科学者にとってはいかなる場合でも”Result is result”です。これに励まされてその後多数の解析を行いました。満を持してNatureに投稿したところ、採択の可否を問う査読に回ったのですが2か月後にあえなく掲載不可の結果が戻ってきました。何とか公表しなければとさらに1年間メタボロトーム解析、プロテオーム解析とお金がかかる実験を行い、再度Natureに投稿したところ今度は査読にも回らず速攻で轟沈。しかしCancer Cellの査読後、たっぷりの追加実験(高額のラジオアイソトープを使った代謝解析実験)を加えて無事に採択となった時には、最初の投稿から2年近くがたっていました。嬉しいというよりはホッとしたというのが正直な気持ちでした。
本学の学生2名が解析に使う2種類の遺伝子改変マウスの作製を行ったこと、宮城がんセンター研究所の動物施設の改修工事のために、発がん実験は本学で100匹のマウスの経過観察を半年間行う(調子が悪くないかを毎日観察)など、人的にも施設的にも本学がかなり関与しているので、「論文として公表できて、みんな本当によかったなあ」でした。ここで紙面が尽きました。詳しい研究内容は図3と論文(2)を参照してください。
図3. 新しく判明したPKM1, 2のエネルギー産生における役割
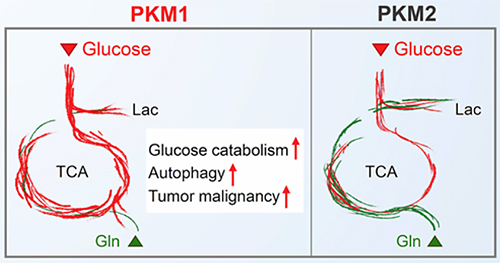
PKM1は、グルコース(Glucose:赤)由来炭素のTCA回路への流入と乳酸(Lac)への変換のいずれをも促進させる(グルコース消費を亢進)。代謝ネットワークの変化が、未解明の制御機構を通じて総乳酸産生を低下させる。PKM2は、グルタミン(Gln:緑)消費を亢進させ、乳酸産生が増加する(グルタミン消費を亢進)。(Cancer Cell 33, 355-367.より図の一部を引用)
参考文献
(1) Christofk HR, Vander Heiden MG, Harris MH, Ramanathan A, Gerszten RE, Wei R, Fleming MD, Schreiber SL, Cantley LC. (2008) The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth.
Nature 452, 230-233. doi: 10.1038/nature06734.
(2) Morita M, Sato T, Nomura M, Sakamoto Y, Inoue Y, Tanaka R, Ito S, Kurosawa K, Yamaguchi K, Sugiura Y, Takizaki H, Yamashita Y, Katakura R, Sato I, Okada Y, Watanabe H, Kondoh G, Matsumoto S, Kishimoto A, Obata M, Matsumoto M, Fukuhara T, Motohashi H, Suematsu M, Komatsu M, Nakayama K, Watanabe T, Soga T, Shima H, Maemondo M and Tanuma N. (2018) Pkm1 confers metabolic advantages and promotes cell-autonomous tumor cell growth.
Cancer Cell 33, 355-367. e7. doi: 10.1016/j.ccell.2018.02.004.(二重下線は本学所属者)

